|
|
Tủ sách tư liệu khoa họcCảnh báo và thu hồiThư cảnh báo
(Warning letter) do công ty săn xuất gởi khi khám phá máy có thể có sự
cố có thể tổn thương bệnh nhân. Lệnh thu hồi (Recall) do một cơ quan
chức trách, thí dụ cơ quan FDA ở Mỹ, ban ra. Ở Mỹ, cơ quan FDA có 3 mức
thu hồi. Mức lệnh thu hồi tùy theo độ nặng sự cố. Nặng nhất là mức 1,
và công ty sẽ phải ngưng bán thiết bị bị thu hồi cùng lúc có chương
tŕnh theo dơi và giải quyết sự cố. Ở mức 2 và 3 th́ thường công ty đă
có chương tŕnh đế giải quyết vấn đề.
 Nếu bạn đang mang một thiết bị có class I recall, bạn phải được công ty thông báo cho biết là thiết bị đó có nguy cơ cao. Nếu bạn không nhân thông báo từ công ty, bạn nên hỏi công ty cung cấp và yêu cầu có bảng dịch ra tiếng Việt (nếu đă đực cung cấp ở VN). Đây là bổn phận của công ty cung cấp. Hiện nay có 3 thiết bị có class I recall:
Chúng tôi chia các cảnh báo và thu hồi ra 2 phần Ngoài ra, công ty Medtronic, tháng 11, 2009, đă bị FDA cảnh cáo v́ những vi phạm trong quy tŕnh thiết kế, sản xuất và theo dơi các thiết bị điều trị nhịp tim. Trong lich sử FDA, đây là lần thứ 2 phải cảnh cáo một công ty tạo nhịp. Công ty trước là Telectronics đă bị xóa sổ. Măi đến tháng 3, 2011 Cty Medtronic mới giải quyết xong cảnh cáo này. Một công ty phải mất 1,3 năm để thay đổi quy tŕnh thiết kế và sản xuất, th́ không biết trong thời gian đó và trước đó có những vấn đề ǵ đă không được che dấu. Chúng tôi nghĩ là trong thời gian tới sẽ có nhiều cảnh báo được công ty gởi ra sau khi đă cập nhật quy tŕnh thiết kế và sản xuất. Công ty St Jude cuối năm 2010 đă đ́nh chỉ cung cấp các dây sốc Riata, Riata ST v́ vỏ dây bị ṃn sớm, bị ḷi dây đồng. Tháng 12, 2011, cơ quan FDA sau khi duyệt lại các báo cáo đă ra lệnh recall class I các dây Riata và Riata ST v́ vấn đề ḷi dây đồng, một vấn đề Cty St Jude cho là vấn đề phụ khi quyết định đ́nh chỉ cung cấp các dây sốc này. Gần đây, sự cố chập mạch các dây đồng với các cuôn sốc đă gây chú ư, v́ là cugn vấn đề dây đồng ḷi ra nhưng xảy ra bên dướii cuộn sốc. Đă có nhà nghiên cứu nêu ra vấn đề là các dây Riata ST Optim và Durata mà Cty ST Jude hiện vẫn tiếp tục cung cấp có thiết kế tương tự 2 dây đá bị thu hồi, nên vấn đề này có thể sẽ lan qua 2 dây mới, nhưng trễ hơn v́ lớp Optim cứng bên ngoài. Đến năm sau, 2012, Cty St Jude đă phải ngưng cung cấp dây thất trái QuickSite và QuickFlex v́ sự cố dây đồng ḷi ra. Ở thời điếm này chất ETFE bên ngoài các dây đồng này đă không gây sự cố điện và chưa gây tổn thương BN, nên FDA chỉ ra lệnh thu hồi cấp II. Đă có báo cáo là mức sự cố này lên >45%. Nếu có báo cáo BN bị tổn thương th́ FDA sẽ chuyển lênh recall này sang Class I! Trong các năm 2010-2012, 2015-2016 cả 2 công ty Medtronic và St Jude đều đă có những đợt recall, trong khi công ty Biotronik không có phải recall bất cứ thiết bị nào cả. Nh́n trong bảng dưới, từ năm 2009 trở đi, trong ṿng 10 năm, chỉ có năm 2014 và 2017 là Cty Medtronic không có recall class I/II trong lĩnh vực điều trị nhịp tim. Trong thời gian đó, Cty St Jude cũng chỉ tránh recall I/II năm 2009, 2013, 2018 và đă có 3 recall class I (nếu kể Nanostim) với >670.000 BN bị ảnh hưởng! Trong thời gian này Biotronik đă không có recall nào hết! Bs Kevin Campbell trong bài b́nh luận về một recall gần đây có than phiền là recall là một thường t́nh trong các công ty điều trị nhịp tim, trừ công ty Biotronik! Để ư là Bs Campbell phân biệt các công ty Mỹ và Biotronik là công ty Đức.  Đoạn tô màu vàng: Chỉ duy nhất Biotronik (một công ty Đức) là không có recall đáng kể trong 5 năm qua. Bs Campbell không có dùng các thiết bị Biotronik nhưng cũng phải công nhận là Biotronik khác các công ty thiết bị điều trị nhịp tim khác . Nhưng Bs Campell lầm ở chổ khoảng thời gian không có recall đáng kể ở công ty Biotronik là 20 năm chớ không phải chỉ 5 năm! =========================================
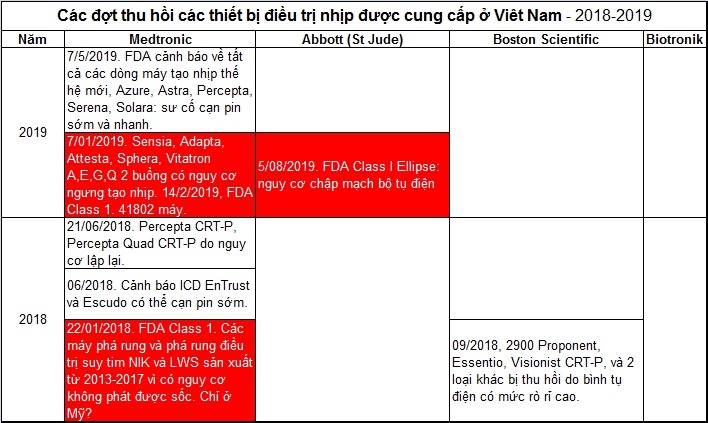
Năm 20195/08/2019 và 20/06/2019. Cty Abbott (trước đây là St Jude) đă ra lệnh thu hồi các ICD Ellipse CD 1411-36Q/ 2411-36Q/ 2411-36C/1377-36C/ 1377-36QC/ 2377-36QC. Ở VN th́ các máy DF-4 (máy với chữ Q) 1 buồng thường được cung cấp (CD 1411-36Q/ 1377-36QC). Lư do là lỗi trong sản xuất đưa đến dây nhôm không có lớp cách điện có thể đưa đến chập mạch b́nh tụ điện (capacitor) và máy sẽ không thể phát sốc được. Chỉ có thể thay máy để tránh nguy cơ. Các máy đước sản xuất từ 5/04/2019 đến 29/05/2019, và được cung cấp từ 6/05/2019 đến 14/06/2019, có nghĩa là được cung cấp ở VN từ giữa tháng 05/2019. Không có cách nào kiểm tra nguy cơ này trong máy được. Lệnh thu hồi tháng 6 gi là chỉ có 204 máy và chỉ các máy 1411/2411, nên chúng tôi không liệt vào danh sách này. Đến tháng 8, FDA đă nâng cấp lên recall class I và có thêm các máy 1377 và 2377. Không rơ số máy là bao nhiêu.7/05/2019. Cơ quan FDA đă có lệnh cảnh báo về 266,700 máy tạo nhịp thế hệ mới của Cty Medtronic (Azure, Astra, Percepta, Senera, Solara), về cạn pin sớm và nhanh do sự cố b́nh tụ điện. Theo Medtronic, nguy cơ nhỏ nhưng không có dấu hiệu cho đến khi pin vào thời gian cạn pin, ERI. Do đó nếu có cạn pin sớm th́ có thể là do nguy cơ này. Đă có một tử vong. 7/01/2019. Cty Medtronic đă ra lênh thu hồi 157.000 máy tạo nhịp 2 buồng Sensia, Adapta, Attesta, Sphera, Vitatron A,E, G, Q khi được lập tŕnh với chương tŕnh tạo nhịp 2 buồng v́ có thể ngưng tạo nhịp cho đến khi có nhận cảm ở thất. Do đó bệnh nhân với tạo nhịp thất 100% có nguy cơ máy sẽ ngưng hoạt động một thời gian dài. V́ chính phủ Mỹ bị đóng cửa, nên FDA chưa có lệnh thu hồi. Chúng tôi nghĩ đây sẽ là Class I, một khi FDA đi làm việc trở lại! 15/02/2019 FDA class I recall. ======================== Năm 201809/2018. Boston Scientific cảnh báo là có 2900 máy tạo nhịp Proponent, Essentio, Visionist CRT-P, và 2 loại khác, có thể cạn pin sớm do mức ṛ ŕ b́nh tụ điện tăng do khí hyđrô trong hộp máy. BN cần tái khám <6 tháng.21/06/2018. FDA đă ra lệnh thu hồi cấp 2 các máy Percepta CRT-P và Percepta Quad CRT-P do một lỗi có thể lập lại (reset) đưa đến điều trị CRT bị gián đoạn. Có 1842 máy với lỗi. 06/2018. Medtronic đă có cảnh báo về các máy phá rung EnTrust và Escudo (không cung cấp ở VN) do cạn pin sớm khi vào cuối thời gian hoạt động. Các máy đă được sản xuất năm 2010, và có 25,000 được bán. Cho đến tháng 10/2018, đă có 30 máy hư được báo cáo. Có khoảng 1700 máy c̣n hoạt động. Hướng giải quyết: nếu pin thất, cần thay máy sớm. 22/01/2018. Cty Medtronic đă ra lệnh thu hồi các máy phá rung trong danh sách dưới đây (sản xuất từ 13/07/2013 đến 8/08/2017)v́ lỗi trong sản xuất có thể đưa đến tạo khí (gă mixtrure) trong máy có thể đưa đến máy không phát sốc được, có thể tổn thương bệnh nhân.
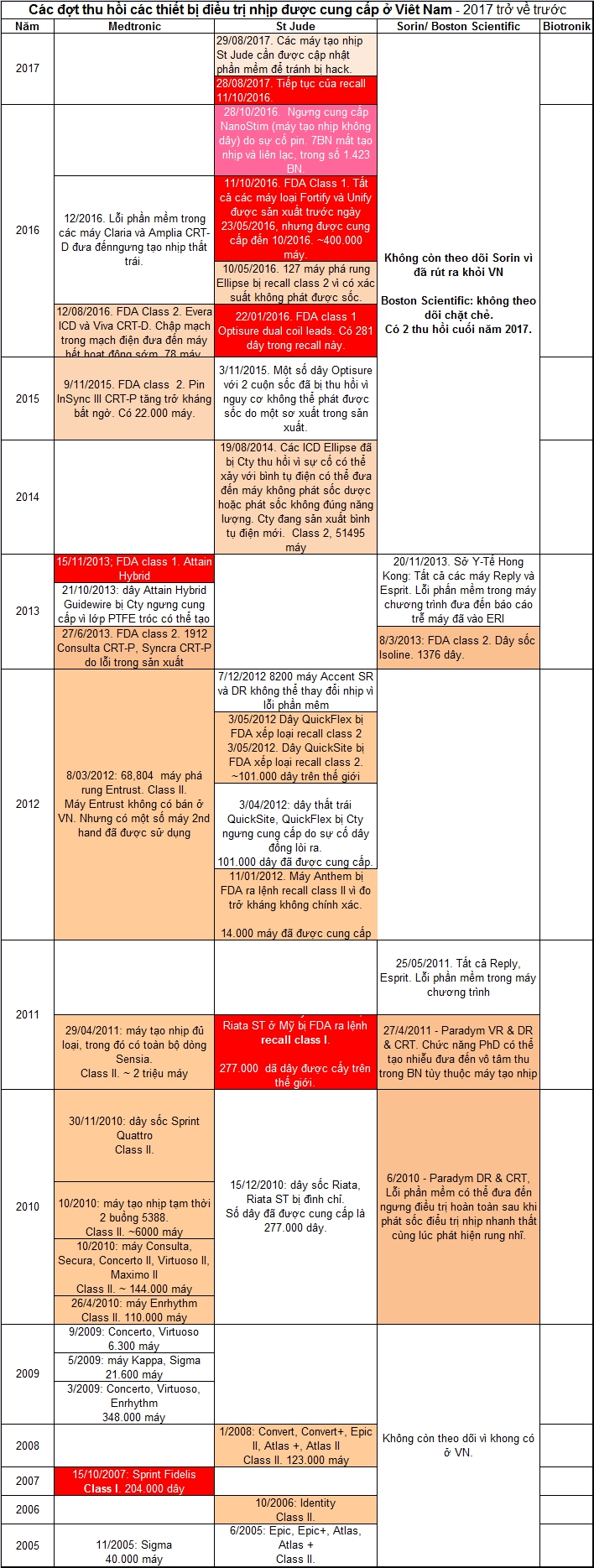
Năm 201729/08/2017. FDA đă ra cảnh báo là các máy tạo nhịp với chức năng theo dơi từ xa cần phải được cập nhật phần mềm để tránh bị hack.28/08/2017. Tiếp theo recall 11/10/2017, Cty St Jude đă cập nhật phần mềm trong các máy phá rung để có thể phát hiện t́nh trạng hụt pin và báo động rung. Vậy cần phải đi kiểm tra máy để cập nhật máy. 9/01/2017. FDA đă xác nhận là các máy điều trị nhịp tim St Jude với theo dơi từ xa được bật ON (ở VN th́ thường không, nhưng có thể có khi bị bật lầm ON) có thể bị hack. ======================== Năm 201612/2016. Do lỗi phần mềm, các máy Claria CRT-D và Amplia CRT-D có thể ngưng tạo nhịp thất trái. Măi đến 04/2018 mới có phần mềm để giải quyết sự cố này.28/10/2016. Cty St Jude đă phải ngưng cấy các máy tạo nhịp không dây (leadless pacemaker) Nanostim v́ sự cố pin đưa đến máy không c̣n tạo nhịp và không thể liên lạc được. V́ máy chưa được FDA cho phép lưu hành, không có recall chính thức từ FDA, nhưng chương tŕnh nghiên cứu FDA đă bị ngưng - tương đương recall class 1? Sự cố xảy ra với 7 BN trong số 1.423 BN đang mang máy. BN tùy thuộc máy được khuyên nên cấy một máy tạo nhịp. 11/10/2016. Cty St Jude đă phải thu hồi các máy phá rung và CRT-D ḍng Fortify, Unify, Quadra Assura, Quadra Assura MP. Cty St Jude đă gửi cảnh báo ngày 11/10/2016 là các máy ICD và CRT-D các ḍng trên sản xuất trước ngày 23/05/2015 có nguy cơ có cụm lithium (lithium cluster) đưa đến chập mạch pin. Khi có sụ kiện cụm Li chập mạch, pin có thể mất hết điện lược trong ṿng 1 đến 30 ngày. Khi xảy ra trong ṿng 1 ngày, th́ máy sẽ không có đủ thời gian để báo động! Cần xem cảnh báo để kiểm tra mă số máy. Có khoảng 400.000 máy trong recall cấp I này. Nguy cơ này th́ khó biết, nhưng điều mà không thể chấp nhận được, là từ 23/05/2015 đến tháng 10/2016, trong thời gian 17 tháng, Cty St Jude vẫn tiếp tục cung cấp các máy với loại pin này! Massdevce.com đă tiếc lộ tin khó tin từ một công ty lớn Mỹ! Các tập đoàn luật sư ở Mỹ đang rất bân rộn về vụ này! Trong một webinar tổ chức bởi hội HRS (nếu không vào được website, mà muốn nghe webinar, hăy liên lạc với chúng tôi) Bs Mark Carlson có cho biết về chương tŕnh ở Mỹ sẽ cho Bs thay các máy trên với một máy mới miễn phí. Chương tŕnh chỉ có hiệu lực đến ngày 9/04/2017. Ngoài ra các BS có thể yêu cầu Cty St Jude cung cấp remote monitoring cho các BN mang các máy này. Các Bs TQ đă can thiệp để các BN được cung cấp remote monitoring miễn phí. Không nghe ǵ về phía VN. 12/08/2016. Cty Medtronic đă gửi thư cảnh báo về các máy phá rung cao cấp Evera và CRT-D Viva có thể có sự cố chập mạch trong mạch điện của các máy có thể đưa đến t́nh trạng hết pin trong ṿng 7 ngày hay ngắn hơn. Cty tin là chỉ có 78 máy đă được sản xuất với mạch điện này. Đă có 7 máy bị sự cố này. Cần xem cảnh báo để kiểm tra mă số. V́ số máy nhỏ, FDA đă giới hạn recall class II. Tuy nhiên các máy này đă được cung cấp ở Mỹ, châu Âu, Úc, Nhật Bản và Đại Hàn. Do đó nếu bạn đă được cấy các máy trên ở các nước được ghi, bạn cũng nên kiểm tra mă số. 10/05/2016. Cty St Jude đă có lệnh recall class 2 máy phá rung Ellipse v́ xác suất không phát được sốc. Trong số 127 máy, đă có máy đă được cung cấp về VN. ================ Năm 201527/11/2015. Cty Medtronic đă có thông báo là các máy CRT-P InSync III có sự cố trở kháng pin tăng bất ngờ sau khoảng 53 tháng hoạt động. Đă có 1 tử vong, va 30 BN đă gặp sự cố. Có khoảng 22.000 máy trong lệnh thu hồi cấp II này.3/11/2015. Cty St Jude đă phải thu hồi một số dây sốc Optisure (8F) với 2 cuộn sốc. Đến ngày 22/01/2016, cơ quan FDA (USA) đă ra lệnh thu hồi cấp 1 các dây này. 19/08/2014. Cty St Jude đă cảnh báo BS và BN (nếu bạn đang mang máy Ellipse, mà chưa nhận được thư tương tự, hăy cho chúng tôi biết) về đợt thu hồi ICD Ellipse các loại. Cty St Jude khám phá ra vấn đề nhờ báo cáo gửi về công ty, và từ phân tích các máy hư được gửi trả. Trong thư cho BS, Cty giải thích hiện tượng là xẹt lửa (arcing) giữa hai trụ a-nốt và ca-tốt của b́nh tụ điện. Khi b́nh tụ điện hư, khi cần phát sốc máy có thể phát sốc đúng năng lượng, không đúng năng lượng sốc hoặc không phát sốc. Thường th́ xảy ra khi tái tạo b́nh tự điện. Sau khi sự cố xảy ra, máy thường có báo động rung. Nếu bạn cảm giác báo động rung, cần phải tới BS kiểm tra máy. Cty không giải thích lư do hư, nhưng có cho biết là các máy được sản xuất trước tháng 8/2012 có xác suất hư cao hơn. Sau tháng 8/2012 v́ đă có thay đổi trong sản xuất, xác suất thấp hơn... như vậy là công ty đă biết có thể có sự cố từ tháng 8/2012! 20/11/2013. Sở Y-Tế Hong Kong có cảnh báo liên quan đến tất cả các máy tạo nhịp Sorin Reply và Esprit. Khi máy gần đến thời gian thay máy (ERI, Elective Replacement Indicator) máy chương tŕnh tính thời gian không dúng nên sẽ báo trễ. Do đó BN có thể không có đủ thời gian để thay máy trước khi máy ngưng hoạt động. Năm 2011 Cty Sorin đă có một cảnh báo tương tự! Bây giờ lại thêm một cái nữa! 15/11/2013. Cơ quan FDA (USA) đă ra lệnh thu hồi cấp I các dây Attain Hybrid dùng trong thủ thuật CRT vf nguy cơ tróc lớp PTFE có thể đưa đến cục đông được tạo trong khi cấy dây thất trái. 27/6/2013. Cơ quan FDA (USA) đă ra lênh thu hồi cấp 2 1912 máy (159 ở Mỹ, 1137 ngoài Mỹ) Medtronic Consulta CRT-P và Syncra CRT-P v́ lỗi trong quy trinh sản xuất. 8/3/2013. Cty Sorin đă phải ra lệnh thu hồi cấp II dây sốc Isoline do chập mạch dây đ̣ng với điện cực sốc. 3/05/2012. Cơ quan FDA (USA) đă ra lệnh thu hồi cấp 2 các dây thất trái QuickFlex và QuickSite của Cty St Jude. 3/04/2012. Cty St Jude đă thông báo ngưng cung cấp dây thất trái QuickFlex v́ sự cố "dây đồng ḷi ra". Cty dự đoán số dây bị sự cố này sẽ lên đến 3-4%. 25/05/2011. Cty Sorin cảnh báo lỗi trong phần mềm máy chường tŕnh khi dùng kiểm tra tất cả các máy Reply và Esprit đưa đến báo cáo máy hết pin (End of Life) và nhịp nam châm 30 n/p (thay v́ 80 n/p). 02/2012. Một dây Tendril của Cty St Jude đă có sự kiện dây đồng ḷi ra. Không biết đây là trường hợp cá biệt hay là ca đầu tiên sẽ đưa đến recall? 01/2012. Máy Anthem của St Jude đă lệnh thu hồi cấp 2 v́ không đo chính xác trở kháng. Dưới đây là bảng tóm tắt. |
Backup VVI Mode
Vấn đề này chưa được lên mức cảnh báo/thu hồi nhưng tùy theo tiến triền có thể lên múc cảnh báo với các máy phá rung St. Jude. Với hệ thống theo dơi từ nhà của Cty St. Jude ở Mỹ và Âu châu, các giới chức trách sẽ có các thông tin chính xác về vấn đề này và có thể sẽ có quyết định.Trong tất cả các máy điều trị nhịp tim (tạo nhịp, phả rung) chỉ có các máy Cty St. Jude là có một h́nh thức hoạt động đặc biệt khi hư. Đó là backup VVI mode với biểu hiện
- >máy tạo nhịp: VVI với nhịp 67,5 n/p, với biên độ xung tối đa và độ rộng 0,6 ms, đơn cực.
- máy phá rung (hardware reset): VVI với nhịp 60 n/p, với biên độ xung tối đa và độ rộng 0,75 ms. Máy không c̣n điều trị các cơn loạn nhịp nhanh.
Triệu chứng ở các BN máy tạo nhịp là bị giựt cơ ở nơi cấy máy không giảm (khi kiểm tra ngường, v́ tạo nhịp đơn cực 5V, BN có thể cảm giác bị giựt ở chổ cấy máy, nhưng cảm giác này chỉ thoáng qua thôi), bị kích thích cơ hoành, mệt khi vận đông (v́ nhịp cố định 67.5 n/p). Đối với BN máy phá rung, th́ nếu chẳng may bị một cơn loạn nhịp thất th́ sẽ không có điều trị ǵ cả, nên nguy cơ tử vong cao nếu xảy ra ngoài bệnh viện.
Muốn t́m hiểu sự lan rộng t́nh trạng này, có thể vào cơ sở dữ liệu (database) MAUDE của cơ quan chức trách FDA (Hoa Kỳ) http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfmaude/search.cfm và dùng Product Problem: Pacer found in backup mode; rồi bấm search. Năm 2010, trong số 271 máy, đại đa số, ~75%, các máy hư là của Cty St. Jude, kế đến là máy của Sorin/ELA (~23%), rồi đến máy của Biotronik, Medtronic. Các báo cáo chúng tôi đọc qua về các máy của Sorin, Biotronik, Medtronic, khi có phân tích của công ty là do ngoại cảnh (lập tŕnh không đúng, dùng dao cắt đốt) hoặc khi pin yếu. Trong trường hợp các máy St. Jude, ngay cả khi có phân tích của nhà sản xuất, nguyên nhân không rơ, và có thể xảy ra với máy mới hoặc máy đă hoạt động lâu năm.
Không phải tất cả các máy hư với hiện tượng backup VVI được liệt kê ở trang web trên. Chúng tôi cũng đă có t́m thấy các máy tương tự trong các trang web MAUDE với mục khác. Các bác sĩ nhiều khi không báo cáo cho FDA, nhất là các BS ở ngoài Mỹ. Ngoài ra, nhiều khi BS không kiểm tra với máy chương tŕnh, nên không biết là máy hư. Các máy phá rung th́ có thể bị bác sĩ hiểu lầm là máy hết pin nên không điều trị nữa. Do đó số máy hư sẽ nhiều hơn.
Một ít máy bị hư là chuyện thường t́nh. Nhiều máy hư là vấn đề thiết kế.
Chúng tôi có gặp h́nh thức backup VVI mode trong máy St. Jude nào chưa?
- Trong khoảng 253 máy St. Jude, từ ḍng Affinity (1999) trở đi, mà Cty Northwest nhận được trong chương t́nh cung cấp máy 2nd hand miễn phí, đă có 17 máy tạo nhịp ở t́nh trạng backup VVI mode, như vậy là tỷ lệ là 7%.
- Chúng tôi đă gặp trường hợp một máy ICD Atlas + VR của một BN tại VN ở t́nh trạng VVI backup hardware reset. Máy này không c̣n điều trị các cơn loạn nhịp BN này đang bị, và BS đă phải can thiệp với máy sốc ngoài da.
- Năm 2013, chúng tôi đă gặp một máy ICD Current VR RF cũ chúng tôi xin ở Mỹ, trong t́nh trạng VVI backup khi kiểm tra lại ở VN.
Khi Cty St. Jude khám phá ra nguyên nhân backup VVI và có biện pháp phần mềm để tránh, th́ sẽ có một recall để tải xuống phần mềm mới. Cho tới khi đó, máy tạo nhịp/phá rung St. Jude trong người bệnh nhân có thể vào bất cứ lúc nào bị hư.
Chúng tôi không biết chính sách của Cty St. Jude có thay đổi hay không, nhưng sau khi đă gửi kỹ thuật viên đến kiểm tra máy, Cty chỉ đồng ư bổi thường máy Atlas+ VR kể trên với máy của Cty và BN sẽ phải trả thêm một số tiền không nhỏ! Trong trường hợp tương tự, các công ty khác đă thay cho máy mới!
Tài liệu tham khảo
- Cảnh báo và thu hồi
- Thu hồi dây điện cực sốc
- Thu hồi dây Riata
- Ḷi dây đồng trong các dây Riata: nguy cơ lâu dài cho BN
- Ḷi dây đồng trong các dây sốc Riata (St Jude): nguy cơ lâu dài cho bệnh nhân? - Phần II
- Bi kịch Riata tiếp tục.
- Riata tại HRS2012
- Riata và Durata
- Cảnh báo và thu hồi các máy tạo nhịp và phá rung
- thành tích an toàn các công ty sản xuất thiết bị điều trị nhịp tim
- Cty Biotronik đạt mức an toàn cao nhất trong các công ty máy tạo nhịp
Bạn có thể liên lạc với chúng tôi qua e-mail về lienlac@tamthuvn.com. Chúng tôi sẽ trả lời bạn trong thời gian ngắn nhất. Cám ơn bạn đă ghé thăm trang web của Tâm Thu và Northwest Signal Processing.
Số lượt truy cập:
Cập nhật: 14/08/2019 Copyright NWSPI 2010 - 2019














